TKI
Angiogenese en VEGF, meer dan alleen de levensader van niercelcarcinoom
Angiogenese gedreven tumoren met immunologische karaktertrekken
Niercelcarcinoom kenmerkt zich door sterk gevasculariseerde tumoren die de controlerende functie van het immuunsysteem ontwijken. Welk pathologisch mechanisme gaat schuil achter de angiogenese bij niercelcarcinoom? Hoe is het immuunsysteem bij het ontstaan en verloop van deze ziekte betrokken? En wat is de relatie tussen angiogenese, VEGF en het immuunsysteem in RCC? Lees verder hoe het zit.
In 2019 stelden medisch oncologen bij 117.631 mensen de diagnose kanker. Van het totaal aantal kankerpatiënten kreeg 2% nierkanker. In absolute cijfers: 2019 telde 2.606 nieuwe nierkankerpatiënten. Het jaar daarvoor overleden 873 mensen aan de ziekte.1
Bij een nierkankerdiagnose is in de meeste gevallen sprake van niercelcarcinoom. Tenminste 16 subtypes niercelcarcinoom staan in de literatuur beschreven waarvan ongeveer 70% zich manifesteert als de heldercellige variant.2 Wilmstumor (nefroblastoom) is een zeldzamere vorm van nierkanker die uitsluitend bij kinderen voorkomt.3 Nefroblastoom laten we buiten beschouwing. Dit artikel gaat over niercelcarcinoom waarbij de pathologische angiogenese, kankerimmunologie en behandelingsmogelijkheden aan de orde komen.
De rol die angiogenese speelt bij niercelcarcinoom
Angiogenese. Een fysiologisch proces waarbij nieuwe bloed- en lymfevaten uit het bestaande vaatbed ontstaan onder invloed van groeifactoren zoals Vascular Endothelial Growth Factor (VEGF).4 Nieuwgroei van bloedvaten is een gewenst effect bij wondheling. Of embryogenese. In het geval van heldercellig niercelcarcinoom (RCC) is de angiogenese pathologisch van aard en speelt het een cruciale rol in zowel het ontstaan als de progressie van RCC.4
Overexpressie van de pro-angiogene groeifactor VEGF is bij RCC in verband gebracht met:
- microvasculatuur met een hoge dichtheid;
- vergevorderde tumorprogressie;
- slechte prognose.5,6,7
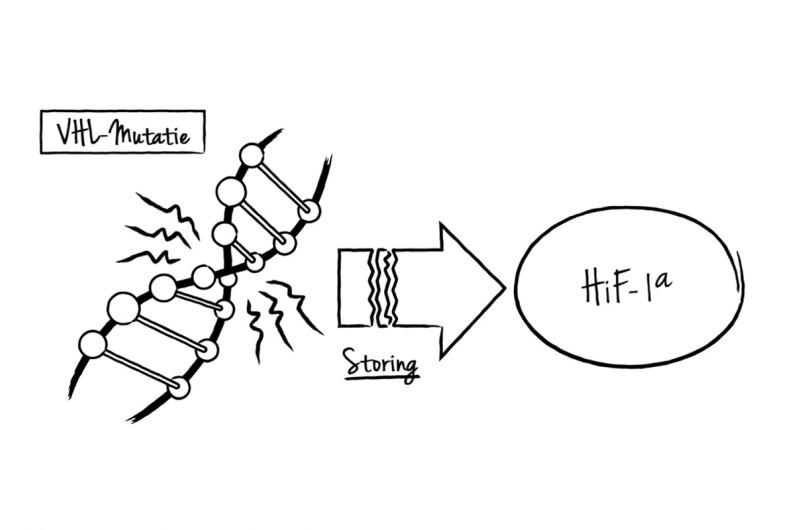
Voordat we de pathologische angiogenese gedetailleerder toelichten, doen we een stap terug. Hoe ontstaat RCC? In het kort: somatische- of epigenetische mutaties van promotors veranderen een bepaald tumorsuppressorgen dusdanig dat het zijn functie verliest.2 Het gevolg? De regulerende functie die het gen uitoefent tijdens celdeling- en replicatie is verstoord. En tumorcellen krijgen de kans om onopgemerkt te groeien.8 Uit de literatuur blijkt dat de meeste patiënten met de diagnose RCC een defect in het tumorsuppressorgen Von-Hippel-Lindau (VHL) vertonen.11,12,17,18,19
Wat heeft het VHL-gen met angiogenese en de overexpressie van VEGF te maken? Door het disfunctionele VHL-gen raakt de verhouding uit balans tussen factoren die angiogenese stimuleren en tegengaan. Die balans helt over naar de zijde waar angiogenese domineert onder invloed van VEGF.5
Het resultaat?
Lekkende, kronkelende bloedvaten bedekt met endotheelcellen die niet op de omgeving reageren. Vaak zijn pericyten afwezig wat gunstig is voor de continuïteit van pathologische angiogenese en metastase.9,10 Het is een ongeorganiseerd hyperpermeabel netwerk van vaten dat solide tumoren van bloed voorziet.5
Dat niet alleen, schrijven Goel et al. (2011). De hoge mate van vascularisatie door angiogenese verandert de tumor micro-omgeving op drastische wijze. Het beïnvloedt de manier waarop kanker groeit, zich ontwikkelt, aan het immuunsysteem ontsnapt, uitzaait en reageert op oncolytica.10
Het is evident dat pathologische angiogenese ten gevolge van het defecte VHL-gen een centrale rol speelt in de ontwikkeling van RCC.5,11,12 Maar hoe uit zich een mutatie van het VHL-gen op celniveau? Hieronder leest u in meer detail over de moleculaire pathologie van RCC.
Het gemuteerde VHL-gen verstoort de harmonie tussen groeifactoren
Misschien herinnert u zich de Nobelprijs voor Fysiologie of Geneeskunde die het comité op 7 oktober 2019 uitreikte? 3 onderzoekers ontdekten hoe cellen op de beschikbaarheid van zuurstof reageren.13
De bekroonde onderzoekers bestudeerden het VHL-gen. Ze toonden aan dat het gen een regulerende functie heeft op de transcriptiefactor HIF-α via een zuurstofafhankelijk biochemisch proces. En waarom is dat relevant voor het begrip van de moleculaire biologie van RCC?
HIF-α reguleert en verhoogt de productie van pro-angiogene groeifactoren zoals VEGF, platelet-derived growth factor (PDGF), erytropoiëtine (EPO) en insulin-like growth factor 2 (IGF2).5,11
In homeostase zijn weefsels voldoende voorzien van zuurstof en wordt HIF-α afgebroken onder invloed van het VHL-gen.
Bij RCC daarentegen verliest het disfunctionele VHL-gen de controle over HIF-α waardoor deze transcriptiefactor zich ophoopt en het de productie van onder andere VEGF overmatig stimuleert.
Daarnaast ondermijnt intratumorale hypoxie het vermogen van het VHL-gen om HIF-α te reguleren. Voor een adequate controle van HIF-α is namelijk zuurstof nodig.5,14 Zoals de Nobelprijswinnaars eerder hadden vastgesteld.13
Nu duidelijk is dat RCC een angiogenese gedreven tumor is waarbij de overexpressie van pro-angiogene groeifactoren zoals VEGF cruciaal zijn, benaderen we het ziektebeeld vanuit immunologisch perspectief. En gaan we op zoek naar het kruispunt waar angiogenese en immunologie elkaar tegenkomen.
Angiogenese ontmoet het immuunsysteem
Net als VEGF-gemedieerde angiogenese heeft het immuunsysteem een actieve rol in de wijze waarop tumoren ontstaan, groeien en metastaseren. Verder lijkt de interactie tussen angiogenese en een gedempt immuunsysteem de ontwikkeling van tumoren en de progressie ervan te vergemakkelijken. Pro-angiogene groeifactoren kunnen immuuncellen direct beïnvloeden. Of indirect via het endotheel.15
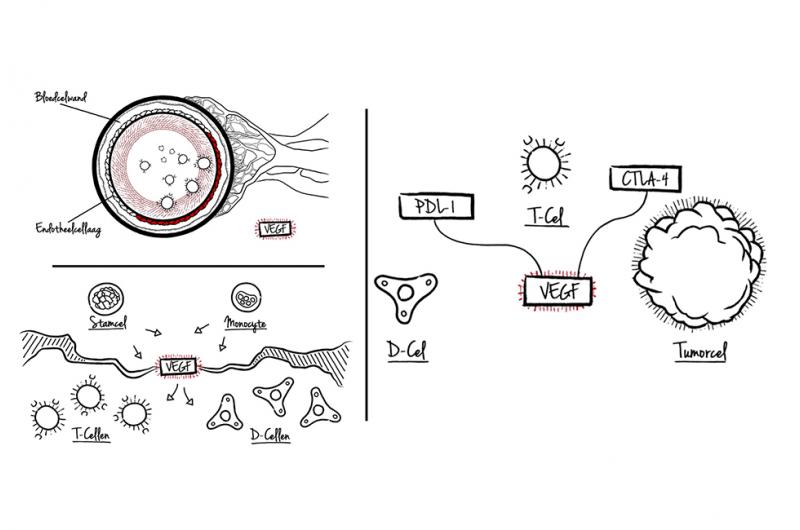
Wat is het directe effect van angiogenese op het immuunsysteem? VEGF: 5,15
- zorgt voor een grotere hoeveelheid checkpoints (PD-1 en CTLA-4) op immuuncellen waardoor overmatig geactiveerde T-cellen hun functie verliezen;
- verhoogt de hoeveelheid myeloid-derived suppressor cellen met immunosuppressieve eigenschappen in de micro-omgeving van de tumor;
- voorkomt differentiatie van stamcellen tot T-cellen wat de specifieke afweer negatief beïnvloedt;
- verhindert differentiatie van monocyten tot dendritische cellen en onderdrukt daarmee het aangeboren immuunsysteem.
Het indirecte effect vindt plaats doordat pro-angiogene factoren het immuuncellen moeilijk maken om het oppervlak van endotheelcellen te passeren. Op die manier wordt immuuncellen de toegang tot tumoren ontzegd. 5,15
Het proces is wederkerig. Op hun beurt veroorzaken immuuncellen angiogenese. Hoe? Door endotheelcellen te laten groeien, migreren en activeren via de productie van pro-angiogene factoren.15
Mennitto et al. (2020) beschreven eerder dit jaar bovenstaande bevindingen zeer gedetailleerd in een review. De auteurs dragen de data aan in aanvulling op de evidence die ondersteunt dat het immuunsysteem en angiogenese nauw verbonden zijn bij RCC.5
De behandeling: angiogeneseremmers en checkpointremmers
In 10 jaar tijd is de 5-jaarsoverleving van RCC-patiënten met 12% gestegen. Van 54% in 2005 tot 66% in 2015. Deze periode overlapt met een tijdperk waarin doelgerichte farmacotherapie op de voorgrond trad en onderdeel werd van de richtlijn voor het behandelen van RCC.16
Het onderzoek naar de rol van angiogenese en VEGF bij RCC legde de fundering voor een medische doorbraak. De EMA keurde in 2006 het eerste antiangiogene geneesmiddel goed: de tyrosinekinaseremmer sunitinib. Meer geneesmiddelregistraties volgden: axitinib, cabozantinib, lenvatinib, pazopanib, sorafenib, tivozanib en bevacizumab.20 Daarna werden immunologische checkpointremmers zoals nivolumab door de EMA goedgekeurd.21
2019 was het jaar waarin de EMA de immuno-oncologische combinatietherapie goedkeurde als eerstelijnsbehandeling voor gevorderd RCC.22,23 Na de registratie van tyrosinekinaseremmers gevolgd door checkpointremmers zijn we op het punt beland waar goedgekeurde farmacotherapie bestaat die tegelijkertijd aangrijpt op angiogenese en het immuunsysteem.
Bronnen
- Nierkanker in cijfers. (2018). KWF en nierkanker - KWF Kankerbestrijding. https://www.kwf.nl/kanker/nierkanker
- Kamli, H., Li, L., & Gobe, G. C. (2019). Limitations to the Therapeutic Potential of Tyrosine Kinase Inhibitors and Alternative Therapies for Kidney Cancer. Ochsner Journal, 19(2), 138–151. https://doi.org/10.31486/toj.18.0015
- Wilms-tumor (nefroblastoom). (2020). Nierkanker.nl – Alles over Nierkanker. https://www.nierkanker.nl/wilms-tumor-nefroblastoom/
- Teleanu, R. I., Chircov, C., Grumezescu, A. M., & Teleanu, D. M. (2019). Tumor Angiogenesis and Anti-Angiogenic Strategies for Cancer Treatment. Journal of Clinical Medicine, 9(1), 84. https://doi.org/10.3390/jcm9010084
- Mennitto, A., Huber, V., Ratta, R., Sepe, P., de Braud, F., Procopio, G., Guadalupi, V., Claps, M., Stellato, M., Daveri, E., Rivoltini, L., & Verzoni, E. (2020). Angiogenesis and Immunity in Renal Carcinoma: Can We Turn an Unhappy Relationship into a Happy Marriage? Journal of Clinical Medicine, 9(4), 930. https://doi.org/10.3390/jcm9040930
- Jacobsen, J.; Grankvist, K.; Rasmuson, T.; Bergh, A.; Landberg, G.; Ljungberg, B. Expression of vascular
endothelial growth factor protein in human renal cell carcinoma. BJU Int. 2004, 93, 297–302.
- Paradis, V.; Lagha, N.B.; Zeimoura, L.; Blanchet, P.; Eschwege, P.; Ba, N.; Benoît, G.; Jardin, A.; Bedossa, P. Expression of vascular endothelial growth factor in renal cell carcinomas. Virchows Arch. 2000, 436, 351–356.
- Cooper GM. The Cell: A Molecular Approach. 2nd edition. Sunderland (MA): Sinauer Associates; 2000. Tumor Suppressor Genes. Beschikbaar op: https://www.ncbi.nlm.nih.gov/books/NBK9894/
- Brown LS, Foster CG, Courtney J-M, King NE, Howells DW and Sutherland BA (2019) Pericytes and Neurovascular Function in the Healthy and Diseased Brain. Front. Cell. Neurosci. 13:282. doi: 10.3389/fncel.2019.00282
- Goel, S., Duda, D. G., Xu, L., Munn, L. L., Boucher, Y., Fukumura, D., & Jain, R. K. (2011). Normalization of the Vasculature for Treatment of Cancer and Other Diseases. Physiological Reviews, 91(3), 1071–1121. https://doi.org/10.1152/physrev.00038.2010
- Sánchez-Gastaldo, A., Kempf, E., González del Alba, A., & Duran, I. (2017). Systemic treatment of renal cell cancer: A comprehensive review. Cancer Treatment Reviews, 60, 77–89. https://doi.org/10.1016/j.ctrv.2017.08.010
- Barata, P. C., & Rini, B. I. (2017). Treatment of renal cell carcinoma: Current status and future directions. CA: A Cancer Journal for Clinicians, 67(6), 507–524. https://doi.org/10.3322/caac.21411
- Drie winnaars Nobelprijs voor Geneeskunde 2019. (2019, 7 oktober). Medisch Contact. https://www.medischcontact.nl/nieuws/laatste-nieuws/nieuwsartikel/drie-winnaars-nobelprijs-voor-geneeskunde-2019.htm
- Semenza, G. L. (2003). Targeting HIF-1 for cancer therapy. Nature Reviews Cancer, 3(10), 721–732. https://doi.org/10.1038/nrc1187
- Rassy, E., Flippot, R., & Albiges, L. (2020). Tyrosine kinase inhibitors and immunotherapy combinations in renal cell carcinoma. Therapeutic Advances in Medical Oncology, 12, 175883592090750. https://doi.org/10.1177/1758835920907504
- “Eerstelijns combinatiebehandeling met pembrolizumab en axitinib bij het gemetastaseerd heldercellig niercelcarcinoom”. (2020). Medische oncologie. https://medischeoncologie.nl/jaargangen/2020/3-apr/eerstelijns-combinatiebehandeling-met-pembrolizumab-en-axitinib-bij-het-gemetastaseerd-heldercellig-niercelcarcinoom.html
- Kim, H. S. (2018). Clinicopathologic Significance of VHL Gene Alteration in Clear-Cell Renal Cell Carcinoma: An Updated Meta-Analysis and Review. MDPI. https://www.mdpi.com/1422-0067/19/9/2529
- Gnarra, J. R., Tory, K., Weng, Y., Schmidt, L., Wei, M. H., Li, H., Latif, F., Liu, S., Chen, F., Duh, F.-M., Lubensky, I., Duan, D. R., Florence, C., Pozzatti, R., Walther, M. M., Bander, N. H., Grossman, H. B., Brauch, H., Pomer, S., Linehan, W. M. (1994). Mutations of the VHL tumour suppressor gene in renal carcinoma. Nature Genetics, 7(1), 85–90. https://doi.org/10.1038/ng0594-85
- Nickerson, M. L., Jaeger, E., Shi, Y., Durocher, J. A., Mahurkar, S., Zaridze, D., Matveev, V., Janout, V., Kollarova, H., Bencko, V., Navratilova, M., Szeszenia-Dabrowska, N., Mates, D., Mukeria, A., Holcatova, I., Schmidt, L. S., Toro, J. R., Karami, S., Hung, R., Moore, L. E. (2008). Improved Identification of von Hippel-Lindau Gene Alterations in Clear Cell Renal Tumors. Clinical Cancer Research, 14(15), 4726–4734. https://doi.org/10.1158/1078-0432.ccr-07-4921
- Zorginstituut Nederland. (2020, 5 oktober). FarmacotherapeutischKompas. FK Online. https://www.farmacotherapeutischkompas.nl/bladeren/groepsteksten/proteinekinaseremmers
- Opdivo. (2020, 24 augustus). European Medicines Agency. https://www.ema.europa.eu/en/medicines/human/EPAR/opdivo#overview-section
- Keytruda. (2020, 24 augustus). European Medicines Agency. https://www.ema.europa.eu/en/medicines/human/EPAR/keytruda
- Bavencio. (2020, 31 augustus). European Medicines Agency. https://www.ema.europa.eu/en/medicines/human/EPAR/bavencio